プレスリリース
報道関係各位
ノバルティス ファーマ株式会社
ノバルティス ファーマ株式会社(本社:東京都港区、代表取締役社長:レオ・リー、以下「ノバルティス ファーマ」)は、本日、家族性高コレステロール血症および高コレステロール血症に対する国内初のLDLコレステロール(以下、「LDL-C」)低下siRNA(低分子干渉リボ核酸)製剤、「レクビオ®皮下注300mgシリンジ」(一般名:インクリシランナトリウム、以下「レクビオ」)について、製造販売承認を取得したことをお知らせいたします。
高LDL コレステロール血症(以下「高コレステロール血症」)は、LDL-C値が 140 mg/dL 以上であることが診断基準と規定されており1、虚血性心疾患、脳梗塞等を含む動脈硬化性心血管疾患(以下「ASCVD」)と密接に関連しています。
また、家族性高コレステロール血症はLDL-Cが血液中で高くなり、若いときから動脈硬化が進んで、血管が細くなったり詰まったりする病気で、特に心臓の血管(冠動脈)に影響が大きく、心筋梗塞や狭心症を引き起こします。一般人口の300人に1人程度と比較的高頻度の遺伝性疾患です。ホモ接合体性と呼ばれる重症のケースは36~100万人に1人以上の頻度と言われており、ホモ接合体性の場合には指定難病となります2。
ASCVD の予防は、動脈硬化の個々のリスクを評価し介入可能な因子を管理することが重要で、LDL-C は喫煙、高血圧、糖尿病等とともに、介入可能かつ主要なリスク因子の一つ1です。特に心疾患イベントを発症したことがあるなど、高リスクの患者では、より厳格なLDL-C管理が求められます。しかし複数の脂質低下療法が利用可能であるにもかかわらず、心疾患イベントの二次予防が必要な患者のLDL-C 管理目標値の達成率は非常に低く、目標値が100 mg/dL 未満の患者で約60%、70 mg/dL 未満の患者で約25%に留まるという報告もある3ことから、長期的かつ確実なLDL-C 低下効果を示し、投与回数が少なく良好なアドヒアランスが見込める新たな治療法が望まれています。
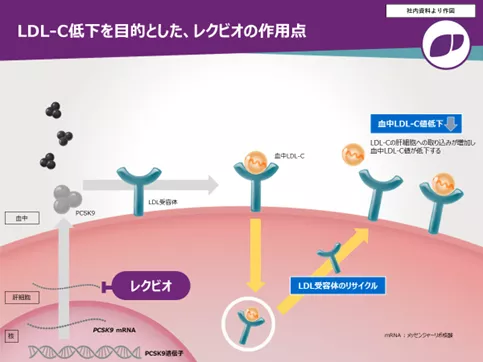
「レクビオ」は、PCSK9蛋白質をコードする mRNAを標的としたsiRNA製剤です。PCSK9は、LDL-Cの肝代謝を促進するLDL受容体を分解して血中LDL-Cの代謝を抑制します。レクビオはGalNAc(N-アセチルガラクトサミン)という構造体を有することで標的組織である肝臓に取り込まれ、肝臓のPCSK9 mRNAの分解を促進することで、LDL受容体によるLDL-Cの取り込みを促進し、血中LDL-C値を低下させます。「レクビオ」は医療従事者によって投与される皮下注射の薬剤であり、投与間隔は初回、3カ月後、以降6カ月に1回であるため、治療アドヒアランスの向上が期待されます。また、複数の脂質低下療法でLDL-C 目標値の達成が困難な高コレステロール血症患者に対する新たな治療選択肢になると考えています。
「レクビオ」の試験結果
今回の承認で評価された試験のうち、主な臨床試験は以下の4試験です。
- ORION-15試験:心血管リスクの高い日本人高コレステロール血症患者312例を対象とした、ランダム化二重盲検並行群間比較試験(国内第Ⅱ相試験)
- ORION-9試験:家族性高コレステロールヘテロ接合体血症患者482例を対象とした、ランダム化二重盲検並行群間比較試験(海外第Ⅲ相試験)
- ORION-10試験:動脈硬化性心血管疾患の既往を有する患者561例を対象とした、ランダム化二重盲検並行群間比較試験(海外第Ⅲ相試験)
- ORION-11試験:動脈硬化性心血管疾患の既往または同等のリスクを有する患者1617例を対象とした、ランダム化二重盲検並行群間比較試験(海外第Ⅲ相試験)
国内第Ⅱ相試験(ORION-15試験)
「レクビオ」又はプラセボを初回、3カ月後、その6カ月後に皮下投与しました。主要評価項目である投与180日目のLDL-Cのベースラインからの変化率(最小二乗平均)はプラセボ群で9.0%、「レクビオ」群で-56.3%であり、変化率の群間差(「レクビオ」群 – プラセボ群)は-65.3%(95% CI:-72.0,-58.6)で、プラセボ群と比較して有意にLDL-C が低下しました(p < 0.0001)。
1年間の治療期間中の副作用の発現割合は「レクビオ」群で13.1%(13/99例)であり、主な副作用は注射部位反応5.1%(5/99例)でした。
海外第Ⅲ相試験(ORION-9、10、11試験)
「レクビオ」又はプラセボを初回、3カ月後、その6カ月後に皮下投与しました。投与510日目 のLDL-C のベースラインからの変化率(主要評価項目)は、プラセボ群で8.22%、0.96%、4.04%(ORION-9、10、11の順、以下同順)、「レクビオ」群で-39.67%、-51.28%、-45.82%であり、変化率の群間差(「レクビオ」群 – プラセボ群)は-47.89%、-52.24%、-49.85%で、プラセボ群と比較して有意にLDL-C が低下しました(いずれもp< 0.0001)。
投与90日後から540日目までのLDL-C のベースラインからの期間平均変化率(主要評価項目)はプラセボ群で6.22%、2.51%、3.35%、「レクビオ」群で−38.08%、-51.27%、-45.82%であり、変化率の群間差(「レクビオ」群 – プラセボ群)は−44.30%、−53.78%、−49.17%で、プラセボ群と比較して有意にLDL-C が低下しました(いずれもp < 0.0001)。
海外第Ⅲ相試験(ORION-9、10、11試験)の「レクビオ」群における18カ月間の治療期間中の副作用の発現割合は24.1%(58/241例)、13.4%(105/781例)、15.2%(123/811例)でした。主な副作用は、ORION-9試験では注射部位紅斑 3.7%(9/241例)、注射部位疼痛 2.5%(6/241例)、注射部位そう痒感 2.5%(6/241例)、ORION-10試験では注射部位疼痛 2.9%(23/781例)、注射部位反応 1.7%(13/781例)、ORION-11試験では注射部位反応 2.2%(18/811例)、注射部位紅斑 1.6%(13/811例)、注射部位疼痛 1.0%(8/811例)でした。
「レクビオ」の開発経緯
「レクビオ」はLDL-C 及びPCSK9 の低下効果を目的とした製品としてRNAi(RNA interference;RNA干渉)治療薬のリーディングカンパニーであるAlnylam Pharmaceuticals社が開発したsiRNA製剤です。ノバルティスは、Alnylam Pharmaceuticals社とのライセンス・提携契約の下で、レクビオの開発、製造および商品化の世界的な権利を取得しています。
欧州では2020 年1 月に承認申請を行い、同年12 月に「原発性高コレステロール血症(家族性ヘテロ接合体及び非家族性)及び混合型脂質異常症」を効能・効果として承認されました。米国では2019 年12 月に承認申請を行い、2021 年12 月に「HeFH 及びASCVD の既往を有する高コレステロール血症」を効能・効果として承認され、 その後2023年7月に、ASCVDの既往が無いものの心血管イベントの発現リスクが高い患者も新たに投与対象に追加され、効能又は効果が「HeFHを含むLDL-C高値の原発性高脂血症」に変更されました。国内では日本人高コレステロール血症患者を対象とした試験(ORION-15)を2020年から実施し、国内および海外で実施した臨床試験データを基に承認申請を行い、本日2023年9月25日に「家族性高コレステロール血症、高コレステロール血症」に対して製造販売承認を取得しました。
「レクビオ」は、2023 年9 月現在、世界約90以上 の国又は地域で承認されています。
ノバルティス ファーマ株式会社について
ノバルティス ファーマ株式会社は、スイス・バーゼル市に本拠を置く医薬品のグローバルリーディングカンパニー、ノバルティスの日本法人です。ノバルティスは、より充実したすこやかな毎日のために、医薬の未来を描いています。ノバルティスは世界で約10万3千人の社員を擁しており、約8億人の患者さんに製品を届けています。詳細はホームページをご覧ください。
https://www.novartis.co.jp
参考文献
- 動脈硬化性疾患予防ガイドライン2022 年版. 一般社団法人 日本動脈硬化学会 https://www.j-athero.org/jp/wp-content/uploads/publications/pdf/GL2022_s/jas_gl2022_2_220926.pdf.
- 一般の皆様へ:家族性高コレステロール血症(FH)についてhttps://www.j-athero.org/jp/general/6_fh/.
- Achievement Rates for Low-Density Lipoprotein Cholesterol Goals in Patients at High Risk of Atherosclerotic Cardiovascular Disease in a Real-World Setting in Japan. J Atheroscler Thromb; (in press).
以上
<参考資料>
レクビオ®皮下注300mgシリンジの製品概要
製品名:
レクビオ®皮下注300mgシリンジ
一般名:
インクリシランナトリウム
効能、効果又は性能:
家族性高コレステロール血症、高コレステロール血症
ただし、以下のいずれも満たす場合に限る。
- 心血管イベントの発現リスクが高い
- HMG-CoA還元酵素阻害剤で効果不十分、又はHMG-CoA還元酵素阻害剤による治療が適さない
《効能、効果又は性能に関連する使用上の注意》
〈効能共通〉
- 適用の前に十分な診察及び検査を実施し、家族性高コレステロール血症又は高コレステロール血症であることを確認した上で本剤の適用を考慮すること。
- 家族性高コレステロール血症以外の患者では、最新のガイドライン等を参考に、動脈硬化性心血管疾患、末梢動脈疾患、糖尿病、慢性腎臓病等の罹患又は既往歴等から、心血管イベントの発現リスクが高いことを確認し、本剤投与の要否を判断すること。
- 家族性高コレステロール血症のうちホモ接合体については、 添付文書「17.臨床成績」の項の内容を熟知し、本剤の有効性について十分に理解した上で、本剤による治療の適否を慎重に判断すること。
〈HMG-CoA還元酵素阻害剤による治療が適さない場合〉
- 本剤は以下に示す患者に使用すること。
- 副作用の既往等によりHMG-CoA還元酵素阻害剤の使用が困難な患者
- HMG-CoA還元酵素阻害剤の使用が禁忌とされる患者
用法及び用量又は使用方法:
通常、成人にはインクリシランナトリウムとして1回300mgを初回、3カ月後に皮下投与し、以降6カ月に1回の間隔で皮下投与する。
《用法及び用量又は使用方法に関連する使用上の注意》
- HMG-CoA還元酵素阻害剤による治療が適さない場合を除き、HMG-CoA還元酵素阻害剤と併用すること。
- 初回投与後の血中脂質値を測定し、患者の状態等も考慮して継続の可否を検討すること。投与を継続する場合は血中脂質値を定期的に検査し、本剤に対する反応が認められない場合には投与を中止すること。
承認条件:
医薬品リスク管理計画を策定の上、適切に実施すること。
承認取得日:
2023年9月25日
製造販売(輸入):
ノバルティス ファーマ株式会社