テレビドラマシリーズ『ゲーム・オブ・スローンズ(Game of Thrones)』をご覧になっていない方に説明をすると、「三つ目のカラス(Three-Eyed Raven)」とは、『ゲーム・オブ・スローンズ』に出てくるキャラクターのことです。「三つ目のカラス」は過去、現在、未来を見ることができます。そして、ノバルティス バイオメディカル研究所(NIBR)にある超解像度顕微鏡もこの愛称で呼ばれています。
この顕微鏡が、アルツハイマー病で破壊された脳神経細胞の過去、現在、未来を解明することで、ノバルティスの新薬の探索を担う研究者を支援しています。
超解像度顕微鏡はその名の通り、光学顕微鏡の中でも超がつく解像度を実現したもので、研究者が細胞のような微細なもの、さらにはその細胞奥深くにある個々の分子までも見ることができるものです。この技術により、アルツハイマー病など、その病態が十分に解明されておらず、現状では根治が不可能な疾患に対する、有効な治療法に迫ることが出来る可能性があります。もともと薬剤候補物質の探索のために開発されたものではないので、ノバルティスは、研究者の顕微鏡による候補物質の探索をサポートできる、データ・サイエンティストの育成にも力を入れています。
一例として、超解像度顕微鏡を用いることで、アルツハイマー病に関連する毒性タンパク質の蓄積、つまり一分子ずつの強固な接着から始まり、最終的に神経細胞の変性と死滅を引き起こす凝集体が形成される過程を、詳細に観察することが出来ます。NIBRでは、この顕微鏡を使ってタウと呼ばれる毒性の高いタンパク質の蓄積のメカニズムを研究しています。
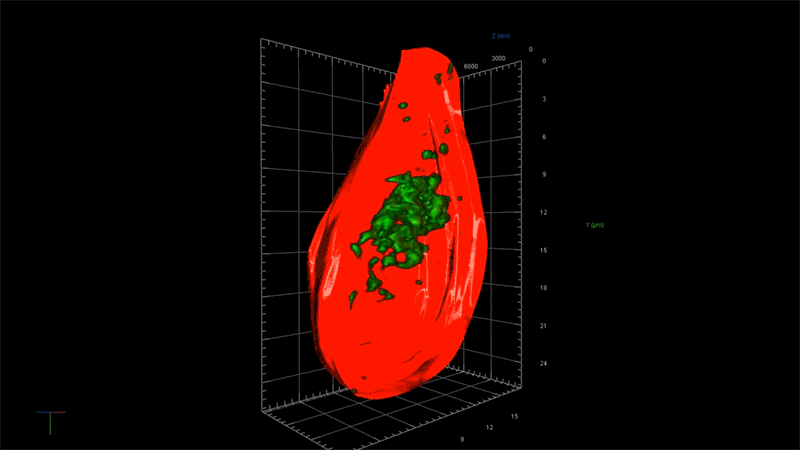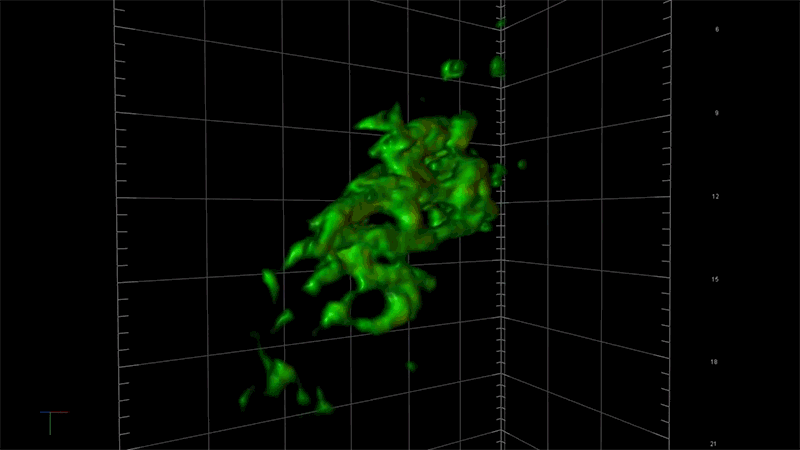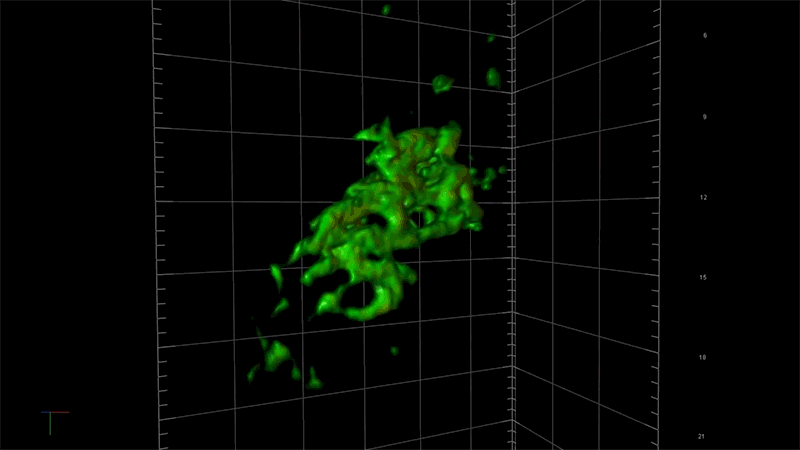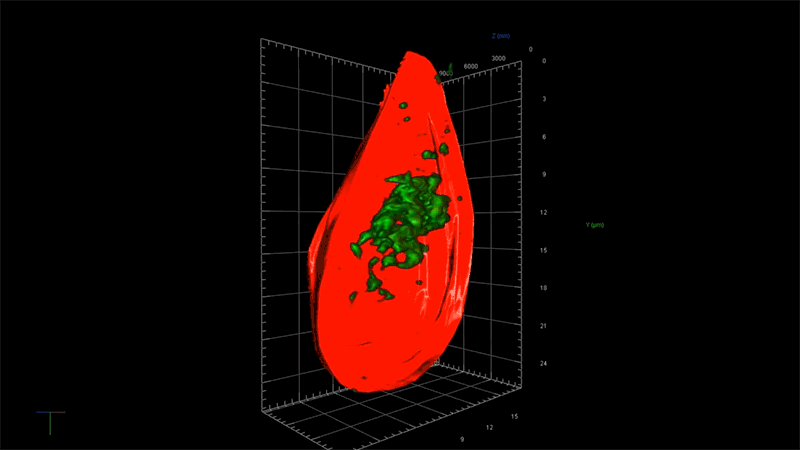
「この顕微鏡を使って、タウ凝集のごく初期の段階を測定する事ができれば、この凝集に影響を及ぼしているものが何であるのかを問うことができます。つまり、どのような遺伝子が関与しているのか?どんな経路をたどるのか?」と、NIBRニューロサイエンスで神経変性疾患チームを率いるフィオーナ・エルウッド(Fiona Elwood)は述べています。「通常の顕微鏡では、大きな凝集体ができるまで何も見えません。」
超解像度顕微鏡で細胞内の奥深くを覗く
通常、顕微鏡は光によって画像を捉えます。どこまで詳細な画像を捉えられるかは、光の特性により限界があります。細胞内の個々のタンパク質分子のように非常に小さいものになると、画像として捉える事はできません。光の波はこれらを照らし出すには大きすぎるのです。
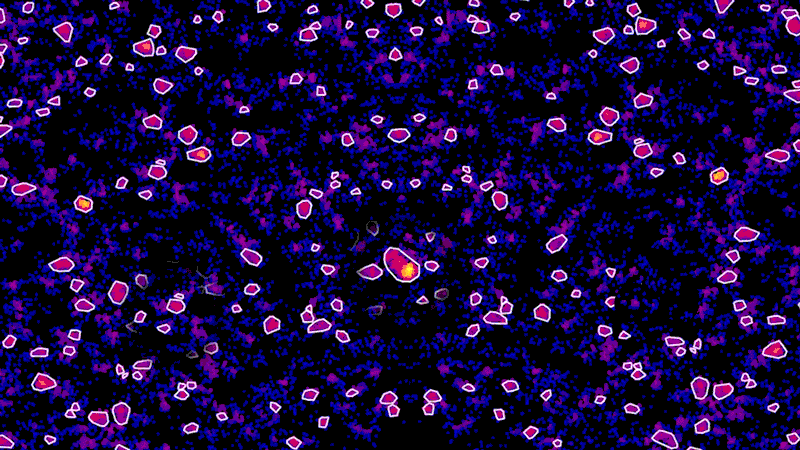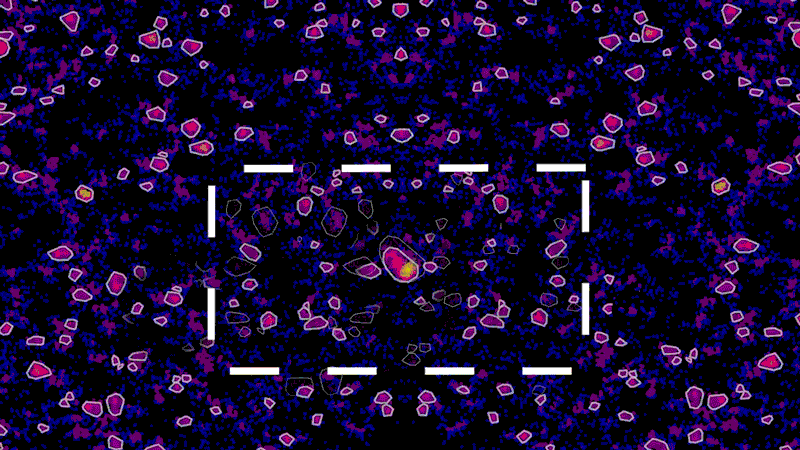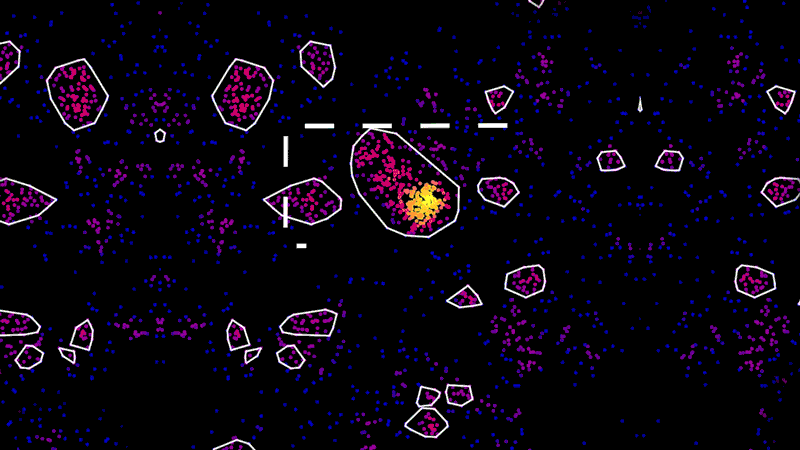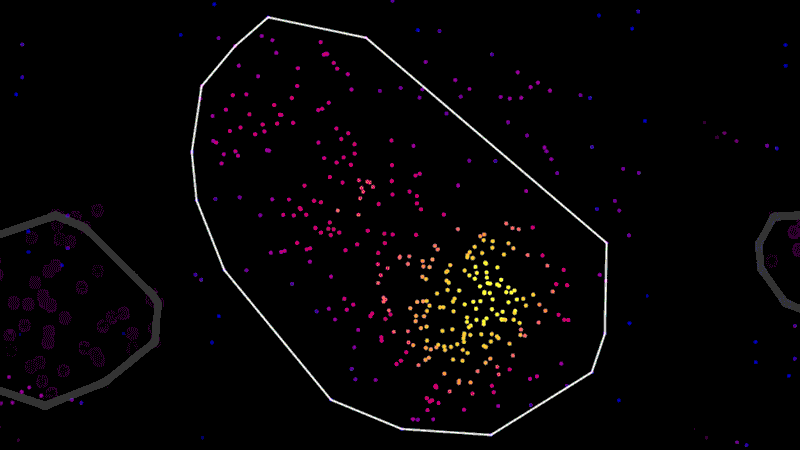
このような限界を克服するため、一部の超解像度顕微鏡ではレーザー技術と蛍光標識を使用しています。蛍光標識を細胞の特定のタンパク質に付着させ、分子をひとつずつ光らせる事で、光学顕微鏡で検出できるようにしています。一連のレーザー照射によって、個別のタンパク質の細胞内でのy局在を顕微鏡で捉えることができます。その上で画像に彩色し、一連のドットとして捉えることも可能です。
「それはまさに、クールなアーティストによる点描画のようです。離れると絵の様に見えますが、近づくとすべてが点に見えます」と、NIBRの顕微鏡部門を率いるネッド・カークパトリック( Ned Kirkpatrick)は言います。
しかし、顕微鏡は点描画家ではありません。位置情報を収集しているにすぎないのです。実際のアーティストの役割を担うのはデータ・サイエンティストです。ツールを構築して、データから物理的に正確、かつ生物学的に意味のある画像に変換しています。

「新たな顕微鏡技術によって、美しいデータが生み出されています。これは、何テラバイトもの生データなのです」と、チームと共に超解像度顕微鏡の神経科学への適用に取り組むノバルティスのデータ・サイエンティスト、ザック・バリー(Zach Barry)は言います。「この化合物のほうがあの化合物よりもよく効いたかというような、科学者たちが解明したい課題に取り組むことは肉眼では不可能です。」
見えるようになったタウのもつれ
実際にタウ凝集がどのように疾患を引き起こすかについては、未だ明らかになっていません。ひとつの可能性として、タウがもつれると微小管という神経細胞内に存在する高速輸送系を支えるどころか、むしろその系を破壊してしまうという説があります。
微小管は常に、細胞体から広範囲へ物質を輸送しています。例えば、神経伝達物質(神経細胞同士の情報伝達を担う化学物質)を検出する受容体を、軸索と呼ばれる蔓の末端まで輸送します。そして、軸索はこの末端で他のニューロンと接続します。タウがもつれると、凝集体が大きな岩が高速道路を塞ぐようにこの高速輸送系を遮断します。これにより、輸送の流れが滞り、情報伝達が阻害され、神経細胞が死に至ります。

NIBRの神経科学チームは、タウのもつれによって障害される脳細胞モデルを作成して、私たちの「三つ目のカラス」で可視化しながらそのメカニズムの理解を深めています。例えば、タウ遺伝子の変化がどのようにそのもつれを加速させるのか、この過程を止めるか遅らせる方法があるのかなどについて、研究者たちは知りたいと考えています。
「これこそが顕微鏡観察に強く惹かれる理由です。生物学そのものをライブでのぞき込むことができるのですから。また、データ・サイエンティストとして、圧倒的な量の豊富なデータを扱うことで、患者さんの人生に影響をおよぼす薬物を探索するプロセスの一端に携わることができるのです」とバリーは語ってくれました。
メイン画像:超解像度顕微鏡でニューロンのチューブリンタンパク質(紫色部分)を示しています。画像提供:Ned Kirkpatrick(ネッド・カークパトリック)、Christina Dornelas(クリスティーナ・ドルネラ)。



